体外诊断试剂全国统一编码来了,每个IVD产品都有了唯一一张“身份证”!体外诊断行业从生产、加工到流通、配送、使用全流程可溯源,试剂、耗材带量采购将畅通无阻!
昨天(8月27日),国家药监局发布《医疗器械唯一标识系统规则》(下称《规则》),要求在我国境内销售、使用的医疗器械,其唯一标识系统都应当符合本规则,从2019年10月1日起施行。
《规则》中说:为贯彻落实《国务院办公厅关于印发治理高值医用耗材改革方案的通知》(国办发〔2019〕37号),规范医疗器械唯一标识系统建设,加强医疗器械全生命周期管理,依据《医疗器械监督管理条例》,制定本规则。
值得注意的是,在8月9日,国家药监局就发布了《关于开展医疗器械唯一标识系统试点工作培训的通知》(下称《通知》),称国家药监局牵头组织开展对医疗器械唯一标识系统试点培训。

第一批参与唯一标识系统试点医疗器械116家企业名单中,罗氏、雅培、贝克曼、西门子、BD、迪安诊断、安图生物等IVD国内外巨头赫然在列!
什么是医疗器械唯一标识系统?
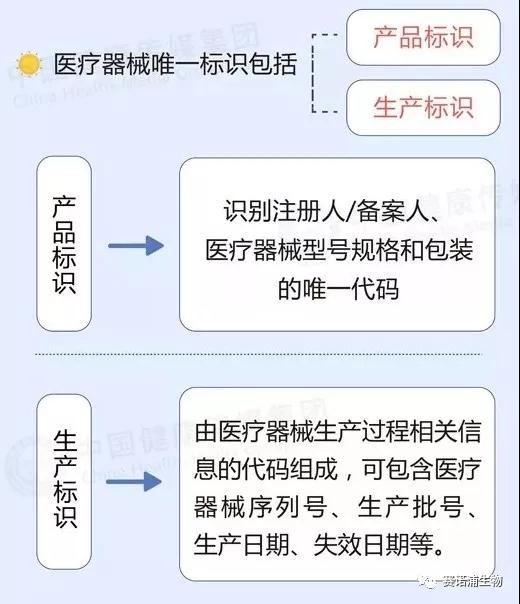
医疗器械唯一标识系统,是对医疗器械在其整个生命周期赋予的身份标识,是其在产品供应链中的唯一“身份证”,它由医疗器械唯一标识、唯一标识数据载体和唯一标识数据库三部分组成。

医疗器械唯一标识,是指在医疗器械产品或者包装上附载的,由数字、字母或者符号组成的代码,用于对医疗器械进行唯一性识别。
医疗器械唯一标识数据载体,是指存储或者传输医疗器械唯一标识的数据媒介。
医疗器械唯一标识数据库,是指储存医疗器械唯一标识的产品标识与关联信息的数据库。
其中,医疗器械唯一标识包括产品标识和生产标识。
产品标识为识别注册人/备案人、医疗器械型号规格和包装的唯一代码;生产标识由医疗器械生产过程相关信息的代码组成,根据监管和实际应用需求,可包含医疗器械序列号、生产批号、生产日期、失效日期等。
医疗器械唯一编码在体外诊断行业如何运行?
之前在6月27日,国家医保局发布《医疗保障标准化工作指导意见的通知》,规定了医保医用耗材编码结构。
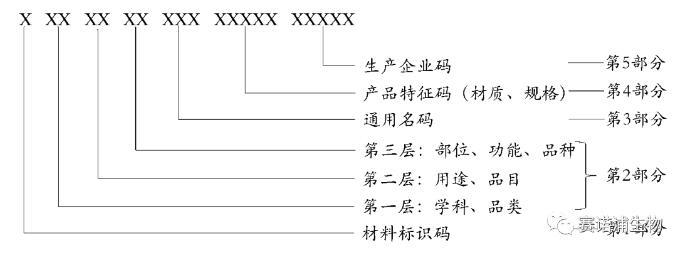
医保医用耗材编码结构
医用耗材编码分5个部分共20位,通过大写英文字母和阿拉伯数字按特定顺序排列表示。其中第1部分是耗材标识码,第2部分是分类码,第3部分是通用名码,第4部分是产品特征码,第5部分是生产企业码。
第1部分:耗材标识码,用1位大写英文字母“C”表示。
第2部分:分类码,根据医用耗材学科、用途、部位、功能划分,用6位阿拉伯数字表示。
第3部分:通用名码,创建全国统一的医保医用耗材通用名码,用3位阿拉伯数字表示。
第4部分:产品特征码,根据耗材材质、规格等特征赋予的代码,用5位阿拉伯数字表示。
第5部分:生产企业码,依据医疗器械注册证或备案凭证为耗材生产企业赋予的唯一代码,用5位阿拉伯数字表示。
文件中表示,国家医保局要求医保医用耗材编码必须具备“唯一性”,形成全国医保系统共建共享的“通用语言”!
值得注意的是,6月27日国家医保局的通知并没有明确把体外诊断产品包含其中。而仅仅过一个多月,体外诊断行业就已经要试行唯一标识编码了!这也反映出,国家政府部门对体外诊断行业的规范化管理正在加深加大!
IVD企业们要怎么做?
《规则》显示,医疗器械唯一标识编制标准应当符合国家药品监督管理局以及符合本规则要求的发码机构制定的相关标准。注册人/备案人应当按照医疗器械唯一标识的编制标准创建、维护医疗器械唯一标识。
注册人/备案人应当选择与其创建的医疗器械唯一标识相适应的数据载体标准,对以其名义上市的医疗器械最小销售单元和更高级别的包装或者医疗器械产品上赋予唯一标识数据载体,并确保在医疗器械经营使用期间唯一标识数据载体牢固、清晰、可读。

注册人/备案人应当按照相关标准或者规范要求上传、维护和更新唯一标识数据库中的相关数据,并对数据的真实性、准确性、完整性负责。
注册人/备案人应当在申请医疗器械注册、注册变更或者办理备案时,在注册/备案管理系统中提交其产品标识。
注册人/备案人应当在产品上市销售前,将产品标识和相关数据上传至医疗器械唯一标识数据库。
医疗器械唯一标识编码的后续影响有哪些?
1、推动IVD试剂“带量采购”全面落地!
在没有全国统一编码前,体外诊断试剂“带量采购”的标准衡量是一个复杂的过程,因为每个厂家使用的试剂原料、产品核心部件、成本控制等都是不一样的。
而在试行体外诊断产品全国编码时,会按照五级分类编码,逐级递增分别为学科、品类、用途、功能、材质、规格、厂商以及最小包装规格,对不同类别的IVD试剂耗材赋予“唯一”码。
实现体外诊断医用耗材全国统一编码后,相当于一个体外诊断产品在全国有了唯一一张“身份证”,打通从生产企业内部到流通、使用所有环节的编码、数据接口、电子数据交换等相关信息的接口,实现全国范围内、医疗器械全生命周期内信息可交换。
而通过实现医疗器械唯一标识后,试剂耗材“带量采购”在全国全面落地的速度将会加快!
2、将IVD第三方物流纳入最严监管!
此次《关于开展医疗器械唯一标识系统试点工作培训的通知》不仅有国内外IVD巨头企业,还有国药、九州通等多家知名IVD第三方物流企业!
早在2017年2月份,国务院印发的《“十三五”国家食品安全规划和“十三五”国家药品安全规划的通知》中就明确提出,制定医疗器械编码规则,构建医疗器械编码体系。打破生产、经营、使用以及监管各个环节信息闭塞、各自为政的局面。
而在全国各省份,上海2006年就实现植入性医疗器械产品必须使用器械唯一标识编码,并将医院使用数据上传到全市统一的追溯管理系统。
而到了2011年,医疗器械第三方物流储运行为也被纳入其中,流通领域也成为重点监管对象。北京、湖南、河北、辽宁都已经建立起器械物流电子监管平台,重庆建立起“两票制”电子溯源监管系统,加强医疗器械流通追溯环节监管。
此次体外诊断产品统一实施唯一器械标识的试行,将打通这最后一层限制,实现全国,乃至与全球范围内体外诊断产品监管统一!